
BTS Travaux Publics - Sujet (en rouge) et correction (en vert)
1- ACOUSTIQUE: ( 6 points ).
On considère 2 sources acoustiques ponctuelles et isotropes S1 et S2 qui provoquent en M, milieu de AB, les niveaux d'intensité N1M = 75 dB et N2M = 70 dB.

1°) Calculer les intensités acoustiques I1M et I2M en M dûes à chacune des 2 sources ainsi que l'intensité totale IM en ce point.
2°) En déduire le niveau d'intensité acoustique NM résultant en M.
3°) Calculer les puissances acoustiques E1 et E2 de chaque source.
4°) En déduire les niveaux de puissance acoustique N1 et N2 des sources.
5°) Calculer les intensités acoustiques I1B et I2B provoquées en B par les sources.
6°) En déduire les niveaux d'intensité N1B et N2B au point B.
7°) Quel est le niveau d'intensité résultant NB en B?
Données:
-puissance acoustique de référence: E0 = 10-12 W
-intensité acoustique au seuil d'audibilité: I0 = 10-12 W.m-2.
1.Correction Acoustique
1°) Intensité acoustique résultante en M
![]()
![]()
Intensité totale: IM = I1M + I2M
IM = 4,16.10-5 W.m-2
2°) Niveau résutant en M:

3°) Calcul de la puissance de la source 1:

Calcul de la puissance de la source 2:
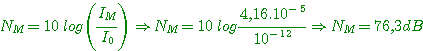
4°) Niveau de puissance N1E:
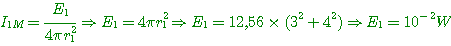
Niveau de puissance N2E:

5°) Intensités acoustiques en B:
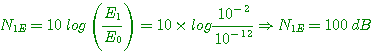
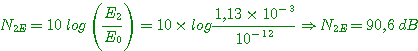
6°) Calcule des niveaux d'intensité en B:
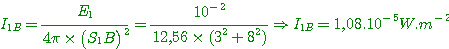

7°) Niveau d'intensité acoustiqe résultant en B:

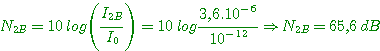
2- THERMODYNAMIQUE (6 points)
A- Un récipient indilatable de 10 L est muni d'un robinet R qui permet de le faire communiquer avec l'atmosphère.
a) R étant fermé, le récipient renferme de l'air à 0°C sous une pression de 1,5 .105 Pa. Quelle est la masse de l'air contenu dans le récipient?
b) R fermé, on chauffe le récipient à 100°C. Quelle est la pression de l'air dans le récipient?
c) On ouvre R, l'ensemble étant maintenu à 100°C. Quelle est la masse d'air qui reste dans le récipient?
d) On ferme R et on ramène l'ensemble à 0°C. Quelle est la pression de l'air dans le récipient?
Données: masse volumique de l'air, à 0°C et sous
la pression atmosphérique normale ( 101 300 Pa ), 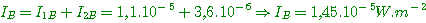 = 1,3 g.L-1.
= 1,3 g.L-1.
2.Correction Thermodynamique:
A-a)
Nombre de moles d'air:
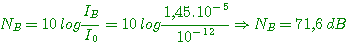


Masse d'air:

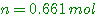
A-b)

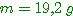
A-c) la pression devient P = 101 300 Pa


A-d) le nombre de moles est lemême que précédemment
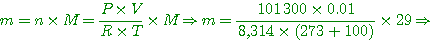

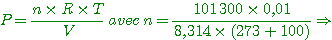
Résultat qu'on aurait pu obtenir en utilisant une isochore
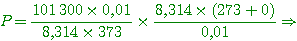
3- CHIMIE (8 points)
1°) Quel corps (formule et nom) obtient-on par addition :
a- de dihydrogène sur du but-1 ène
b- de chlorure d'hydrogène sur du but-2 ène
c- de dichlore sur du 2-méthylprop-1 ène
d- d'eau sur du 2,4-diméthylpent-2 ène ?
2°) On réalise la polymérisation de l'alcène suivant :
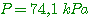
a) Quel est son nom ?
b) Donner la définition d'une réaction de polymérisation par poly-addition.
c) Quel composé l'alcène ci-dessus donne-t-il par poly-addition ?
d) Le degré de polymérisation moyen est n = 50 000. Quelle est la formule brute moyenne du polymère obtenu. Calculer sa masse molaire.
e) Ecrire l'équation de la combustion de cette matière plastique.
f) On fait brûler 100 g du polymère. Calculer le volume d'air nécessaire, le volume d'eau et de dioxyde de carbone formés.
g) Calculer l'énergie thermique dégagée par ces 100 g, sachant qu'elle est donnée par l'expression :

où m est la masse en grammes du corps et n le nombre d'atomes de carbone dans la molécule.
où m est la masse en grammes et n le nombre d'atomes de carbone dans la molécule.
Données : Volume molaire des gaz parfaits : 25 L.mol-1
C = 12 g.mol-1
O = 16 g.mol-1
H = 1 g.mol-1
3.Correction Chimie:
(correction par Marion C. et Amandine B. de 1ère AA2)
1°)
|
|
+ |
|
|
|
|
but-1 ène |
|
dihydrogène |
|
n-butane |
|
|
+ |
HCl |
|
|
|
but-2ène |
+ |
chlorure d'hydrogène |
|
2-chloro butane |
|
|
+ |
|
|
|
|
2-méthylprop-1 ène |
+ |
dichlore |
|
1,2-dichloro 2-méthylpropane |
|
|
+ |
|
|
|
|
2,4-diméthylpent-2 ène |
+ |
eau |
|
2,4-diméthylpentan-2 ol |
2° a)
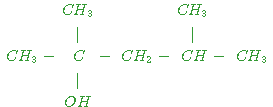 est
le 2-méthylbut-2 ène
est
le 2-méthylbut-2 ène
b) La polymérisation est une réaction chimique au cours de laquelle un très grand nombre de petites molécules A appelées monomères se lient un très grand nombre de fois les unes aux autres pour donner des molécules géantes appelées macromolécules de structure
 .
.
c)
|
|
+ |
|
+ |
|
+
...... 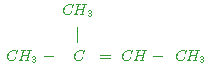
.....  .....
.....
ou

d) Formule
brute du monomère: 
Masse
molaire du monomère: 
Masse
molaire du polymère: M = 3 500 000  ou M = 3,5
ou M = 3,5 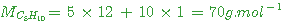
e) Equation de la combustion de cette matière plastique:

f) Il faut d'abord le nombre de moles du polymère

L'équation chimique montre que

Rappelons la composition chimique approximative de l'air: N2 (80%) et O2 (20%).
Il faut 5 fois plus d'air que de dioxygène soit un nombre de moles d'air
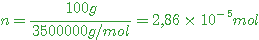
on obtient

et
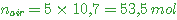
soit
|
volume d'air |
V = 53,5 x 25 |
|
|
masse d'eau |
M = 7,15 x 18 |
|
|
volume d'eau |
|
|
|
volume de dioxyde de carbone |
V = 7,15 x 25 |
|
g) chaleur dégagée:
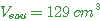
|
|