
avec Charline Cassany et Tiffany Quang - 2nde 9.
1. Principe:
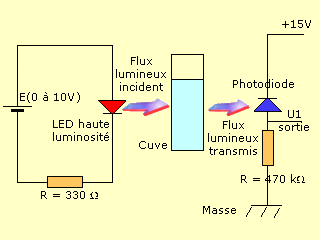
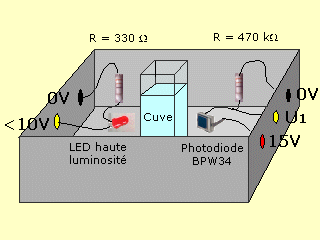
La teinte d'une solution dépend de la concentration de l'espèce chimique qui la colore. Dans le module colorimètre de la valise MPI 2, une D.E.L. haute luminosité éclaire une cuve contenant une solution colorée. Cette solution absorbe plus ou moins de la lumière selon sa concentration. En aval de la cuve se trouve un capteur de lumière: une photodiode BPW34. Cette photodiode, qui fonctionne dans le sens passant comme dans le sens bloqué, laisse passer un courant d'autant plus intense qu'elle est éclairée. La tension U1 aux bornes de la résistance de 470 kΩ augmente donc, elle-aussi, avec l'intensité du flux lumineux transmis par la cuve et la solution colorée. Nous pouvons donc lier un flux lumineux à une tension électrique.
|
|
|
On va placer tour à tour ces solutions dans la cuve du module colorimètre de la valise MPI2 et noter à chaque fois la valeur de la tension de sortie U1.
La référence qu'on appelle le blanc sera faite avec de l'eau distillée et on règlera le générateur d'entrée pour avoir une tension de sortie U0 = 5V.
Cette opération qui consiste à faire la blanc sera répétée à chaque changement de solution.
II/ Préparation de la solution mère
Pas de bécher ni de erlenmeyer.
On dispose de sulfate de nickel heptahydraté réduit en poudre fine par un pilon dans un mortier:

On veut 50mL d'une solution de concentration 0,2 mol/L pour les groupes 1-2-3-4 et 0,15 mol/L pour les groupes 5-6-7-8.
---> Calcul de la quantité de matière (qdm) à peser: C = n / V donc n = C x V :
n1 = 0,2 x 0,05 = 0,01 mol et n2 = 0,15 x 0,05 = 0,0075 mol
---> Calcul de la masse à peser : n = m / M donc m = n x M :
m1 = 0,01 x M(NiSO4 7H2O) => m1 = 0,01 x 280,87 donc m1 = 2,81 g (groupes 1-2-3-4)
m2 = 0,0075 x M(NiSO4 7H2O) => m2 = 0,0075 x 280,87 donc m2 = 2,11 g (groupes 5-6-7-8)
---> On pose un sabot ou une capsule sur le plateau d'une balance et on la tare en vérifiant qu'elle mesure bien en gramme. Grâce à une spatule on prélève de la poudre jusqu'à atteindre la masse souhaitée.
---> On place un entonnoir sur une fiole jaugée de 50 mL à moitié remplie d'eau distillée. On verse la poudre du sabot dans la fiole jaugée puis on rince à l'eau distillée le sabot et l'entonnoir en récupérant l'eau de rinçage dans la fiole jaugée.
---> On agite jusqu'à dissolution complète.
---> On complète avec de l'eau distillée jusqu'à 5 mm au dessous du trait de jauge. On laisse reposer pour que s'effectue le drainage du col de la fiole. On termine au goutte à goutte à la pipette Pasteur jusqu'au trait de jauge
---> On bouche, on étiquette.
La fiole jaugée garantit le volume contenu et pas le volume versé. Elle sert à prélever "in situ" pour préparer d'éventuelles solutions filles.
On dilue 2 fois puis encore 2 fois chacune des 2 solutions mères pour obtenir toutes les solutions souhaitées.
Voir en images une variante de ce protocole .
III/ Mesures et courbe:
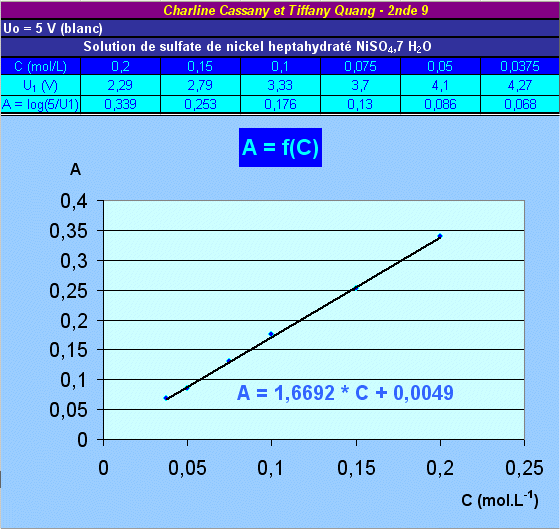
On obtient A = k * C avec k =1,67.
Pour connaître la concentration d'une solution de sulfate de
nickel on en verse dans une cuve du colorimètre et on mesure U1. Puis on
calcule log ( U0/U1), U0 étant la valeur de U1 pour le blanc. Ensuite on
reporte cette valeur sur le graphique et on lit la concentration.
Autre façon:
si on connait la constante k on calcule C = A/k.
|
|
|
Le graphique de droite est obtenu avec une solution de CuSO4.
4. Transformation de l'ordinateur en colorimètre:
Il faut relier le module colorimètre au module d'acquisition sur la voie 0, calibre 0/5V (jumper absent), lequel transmet les données à l'ordinateur via le port imprimante.
