
Evolution des systèmes chimiques
Réalisons le système chimique suivant
|
en apportant les solutés acide méthanoïque, éthanoate de sodium., méthanoate de sodium, acide éthanoïque.
Les couples acido-basiques mis en jeu sont
|
|
Les espèces chimiques présentes en solution sont
|
|
|
|
|
|
|
|
|
|
|
|
Ces 7 espèces chimiques sont partenaires dans les équilibres chimiques suivants:
|
La constante d'équilibre du système à l'étude vaut:
|
Réalisons 3 mélanges à une concentration initiale et commune de chaque espèce apportée C = 1,00.10-1 mol.L-1
et examinons l'observable pH lorsque celui-ci ne varie plus
|
Mélanges -------------> |
S1 |
S2 |
S3 |
|
acide méthanoïque V1 = |
10 mL |
2 mL |
2 mL |
|
méthanoate de sodium V2 = |
10 mL |
10 mL |
10 mL |
|
acide éthanoïque V3 = |
10 mL |
20 mL |
20 mL |
|
éthanoate de sodium V4 = |
10 mL |
2 mL |
10 mL |
|
K = 10 |
|||
|
Qr , i = |
1 (< K) |
50 (> K) |
10 (= K) |
|
Qr , i / K = |
0,1 (< 1) |
5 (> 1 ) |
1 (= 1) |
|
pHéqu = |
4,43 |
4,07 |
4,42 |
|
Qr , éq = |
10 |
10 |
10 |
|
Tous les Qr tendent vers K = 10 |
|||
Pour calculer le quotient de réaction initial Qr , i on utilise la définition:
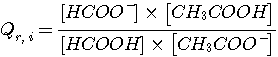
compte tenu des concentrations en soluté apporté et de l'effet de dilution
Pour chacune des 4 concentrations:

Pour calculer le quotient de réaction final Qr , équ on utilise l'observable pH et les expressions vues en cours:
|
|
|
|
Critère d'évolution spontanée:
|
|
|
|