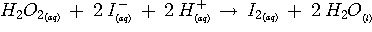
Suivi temporel expérimental par titrage d'une réaction chimique
1. Réaction étudiée: c'est la réaction, en milieu acide, entre les ions iodures I - et le peroxyde d'hydrogène H2O2 ou eau oxygénée.
La réaction à l'étude est la suivante: (Volume réactionnel = 210 mL)
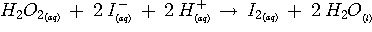
Toutes les espèces chimiques sont incolores sauf le diiode.
La réaction de titrage est la suivante: (Prise d'essai de volume 10mL prélevé dans le mélange réactionnel précédent )

2. Protocole expérimental:
a) Préparation des réactifs: sur la paillasse professeur on prépare les 3 solutions suivantes:
|
|
L'acide sulfurique H2SO4 est un diacide: 1 mole de ce diacide libère 2 moles d'ions H +.
On peut déjà déterminer le réactif limitant:
|
Equation chimique: |
|
|
|
|
|
|
|
Volumes initiaux: |
100 mL |
100 mL |
10 mL |
|
0 |
excès |
|
Concentrations initiales avant mélange: |
0.06 mol.L-1 |
0,2 mol.L-1 |
2 mol.L-1 |
|
0 |
|
|
QDM initiales avant mélange: |
6 mmol |
20 mmol |
40 mmol |
|
0 |
excès |
L'équation chimique et le mode opératoire montrent que c'est H2O2 le réactif limitant, sa concentration initiale dans le mélange vaut:

I - et H + dont il faudrait 12 mmol pour consommer tout le peroxyde d'hydrogène H2O2 sont nettement excédentaires. Les ions potassium K + et sulfate SO42- sont spectateurs.
L'équation de la réaction montre que la quantité de matière maximale de diiode formé est 6 mmol et que sa concentration maximale vaut elle aussi [ I2 ] max = 28,6 mmol.L-1.
b) Titrage du diiode formé: la réaction de titrage est la suivante:

Les ions thiosulfate décolorent progressivement le mélange en éliminant le diiode.
|
|
Chaque binôme vient prélever, au bureau, le plus vite possible, v =10 mL du mélange réactionnel grâce à une pipette ( 1 trait ou 2 traits ) de 10 mL puis le verse dans un bécher propre et sec de 50mL.
La réaction se poursuit dans le bécher tant qu'on n'a pas fait une trempe.
À une date t attribuée à chaque groupe mais différente d'un groupe à l'autre, on introduit dans le bécher de la glace pilée pour arrêter la réaction.
Avant le titrage on introduit dans le bécher quelques gouttes d'empois d'amidon, révélateur de diiode.
Le binôme procède au titrage, goutte à goutte, jusqu'à la décoloration, note le volume V de solution de thiosulfate de sodium à l'équivalence ainsi que la date t de la trempe.
Une dizaine de mesures réparties sur 45 minutes couvre le phénomène.Chaque binôme note au tableau ses valeurs en vue de tracer une courbe commune.
3.Exploitation des résultats:
On remplit le tableau suivant:
TS 1 - Groupe 1 -TP du samedi 17 septembre 2005- Mesures:
|
t(s) |
30 |
210 |
375 |
550 |
900 |
1204 |
1635 |
2820 |
|
|
|
V(S2O32-) (mL) à l'équivalence |
1 |
5,6 |
8,5 |
9,5 |
11,2 |
12,2 |
13,6 |
14,5 |
|
|
|
n(I2) = CV/2 où C = 0,04 mol/L |
0,02 |
0,112 |
0,17 |
0,19 |
0,224 |
0,244 |
0,272 |
0,29 |
|
|
|
[I2] = n(I2)/v (mmol/L) où v = 10 mL |
2 |
11,2 |
17 |
19 |
22,4 |
24,4 |
27,2 |
29 |
|
|
TS 1 - Groupes 1 et 2 -TP du samedi 17 septembre 2005- Courbes:
|
|
Les 3 premiers binômes du groupe 2 ont oublié l'empois d'amidon mais ce sont surtout les mesures à t = 1 800 s et t = 3 900 s qui paraissent mal menées. Si on élimine ces 2 mesures, on obtient ceci:
|
|
La courbe du groupe 1 semble tendre vers la limite théorique [ I2 ] max = 28,6 mmol.L-1. La transformation semble donc être totale.
Le mélange réactionnel et la prise d'essai ont des volumes dans le rapport de 210 à 10; il en est de même pour les qdm de I2 formé, il s'en suit que la concentration de diiode formé est la même dans l'erlen de 250 mL et dans le bécher de 50 mL.
Au début, la concentration de diiode augmente vite, c'est pourquoi le premier binôme devait se dépêcher pour obtenir une mesure vers t = 0.
La vitesse volumique v a pour définition:

Elle est numériquement égale au coefficient directeur de la tangente à la courbe à l'instant considéré.
A l'instant zéro, pour le groupe 1, en considérant que les 3 premiers points sont alignés (tangente confondue avec arc de courbe entre t1 = 0 s et t2 = 210 s), on ontient:

4. Tracés de courbes avec un tableur: la courbe de la fonction f(x) = √ x, (0 < x < 14). on ouvre une page en double-cliquant sur l'icône du tableur et on l'enregistre tout de suite en lui donnant un titre par exemple "Tracés de courbes". On écrit l'entête x dans la cellule A1 et RACINE(x) en cellule A2 si l'on veut tracer la courbe de la fonction racine carrée. On sélectionne la cellule C1 puis on clique sur le signe = pour introduire une formule attribuée à cette cellule C1.
|
|
On veut maintenant avoir les nombres x de 1 en 1 et de 0 à 13. On tape B1 + 1 dans la zone de formule pour attribuer à C1 le contenu de la cellule B1 augmenté de 1. Pour taper B1 on peut aussi cliquer sur la case B1. On confirme grâce à OK.
|
|
Il apparait 1 dans la case C1 puisque la case B1 est vide (valeur par défaut --> 0). On veut répéter cette opération (ajouter 1) jusqu'à obtenir le nombre 13. Pour cela un clic droit et on copie le contenu de C1:
|
|
On sélectionne toutes les cellules de D1 à O1 et on colle le contenu de C1:
|
|
La ligne des x se remplit de 0 (qu'on peut ajouter) à 13.
|
|
On sélectionne ensuite la case B2 pour lui affecter la racine carrée du contenu de la cellule B1. On clique sur le signe = de la barre de formules puis 3 cases plus à gauche, sur la flèche noire pour chercher la fonction que l'on veut appliquer. Si cette fonction "RACINE" ne figure pas dans la liste des dernières fonctions utilisées, on va la chercher grâce à "Autres fonctions".
|
|
On sélectionne la fonction. Entre les parenthèses on tape B1 ou on clique sur la case B1 et on valide avec OK.
|
|
Grâce à un clic droit on copie le contenu de cette cellule et on le colle dans les cellules de C2 à O2. on obtient ceci:
|
|
Une fois sélectionnées les valeurs x et RACINE(x) on clique sur l'icône "graphique" et on choisit "Nuages de points" et l'option "reliés par une courbe lissée".
|
|
On clique sur "Terminer" et il apparait la courbe:
|
|
On a sauté les étapes "Suivant" car on peut travailler après coup sur la courbe: Titre, nom des axes, quadrillage, couleurs, grosseur et forme des points...
En ce qui concerne les mesures physiques, celles-ci n'étant pas régulières en général, on tape toutes les abscisses et toutes les ordonnées comme on l'a fait pour ce TP et à ce moment là on n'utilise pas la barre de formule sauf si on veut obtenir le comportement théorique du phénomène connaissant la formule à laquelle il obéit.
|
|
|