
- Traduction physique: au cours d’une transformation infinitésimale d’un système fermé dont l'énergie cinétique macroscopique est constante:
|
|
dU est la variation d’énergie interne,  représente l’échange de chaleur et
représente l’échange de chaleur et  l’échange de travail.
l’échange de travail.
|
Pour une transformation finie, |
|
On évitera l'écriture |
W et Q dépendent du chemin suivi par la transformation mais leur somme
 n'en dépend pas.
n'en dépend pas.
- Convention de signe: si  > 0, le système reçoit effectivement de la chaleur de l’extérieur.
Si Q < 0, le système donne effectivement de la chaleur au milieu
extérieur. Même convention de signe pour le travail.
> 0, le système reçoit effectivement de la chaleur de l’extérieur.
Si Q < 0, le système donne effectivement de la chaleur au milieu
extérieur. Même convention de signe pour le travail.
- Travail des forces de pression:
|
|
Pext 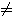 Cte, en général
Cte, en général
Si la transformation est réversible ou même simplement quasi-statique du
point de vue mécanique, Pext  Pfluide et l’on peut utiliser l’équation d’état de celui-ci
ou toute autre équation vérifiée par le fluide. On aura tout intérêt à trouver
une expression P = f (V) pour faciliter l'intégration ultérieure.
Pfluide et l’on peut utiliser l’équation d’état de celui-ci
ou toute autre équation vérifiée par le fluide. On aura tout intérêt à trouver
une expression P = f (V) pour faciliter l'intégration ultérieure.
- Cas d'une transformation finie:
|
|
- Signification géométrique du travail dans un diagramme (P,V) ou diagramme de Clapeyron:
On ne peut représenter une transformation par une courbe que si chacun des points de celle-ci représente un état bien défini du gaz. La transformation doit être quasi-statique ou réversible pour être représentable par un diagramme.
Soit un gaz qui évolue de façon quasi-statique de A à B.
|
|
Lorsque son volume a varié de dV, variation assez petite pour que la pression soit constante sur ce trajet infinitésimal, le gaz a échangé le travail - PdV, quantité opposée à l'aire hachurée.
Dans un diagramme de Clapeyron, le travail des forces pressantes échangé par un gaz qui évolue de façon quasi-statique est opposé à l'aire "sous" la courbe.
Il est alors aisé de constater que:
- Le travail dépend du chemin suivi:
|
|
Pour aller de A à B, l'aire, et donc le travail, ne sont pas les mêmes suivant que le trajet est direct ou que l'état du gaz passe par I ou par J.
Il s'ensuit que la chaleur QAB dépend aussi du chemin suivi car, U étant une fonction d'état, elle est indépendante du chemin suivie; mais toujours égale à W + Q.
|
|
- Pour un cycle:
|
|
Wcycle = - aire ( sous AIB ) - aire ( sous BJA ) = - Aire du cycle.
Note: dans un diagramme de Clapeyron, les isothermes et les adiabatiques d'un gaz parfait sont toutes les 2 à pente variable mais négative. L'adiabatique est plus pentue que l'isotherme qui passe par le même point.
- Enthalpie H: c’est une fonction d’état, donc
sa variation 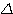 H ne dépend que des états initial et final mais pas du chemin suivi par la transforatation).
L'enthalpie H est définie de la façon suivante:
H ne dépend que des états initial et final mais pas du chemin suivi par la transforatation).
L'enthalpie H est définie de la façon suivante:
|
|
Comme U et PV, elle s'exprime en joules.
Pour une transformation infinitésimale,
|
|
- Transformation isochore:
|
|
|
|
|
pour un fluide qui évolue à volume constant |
(Q est souvent notée Qv et désignée par chaleur à volume constant. On peut mesurer des chaleurs de réaction à volume constant dans des bombes calorimétriques)
- Transformation entre 2 états tels que P = Pext:
|
|
|
|
|
|
||
(Q est souvent notée QP et désignée par chaleur à pression constante)
En thermochimie, on donne souvent les chaleurs de réaction  à pression constante (pression atmosphérique).
à pression constante (pression atmosphérique).
-Transformation adiabatique:
|
|
- Transformation cyclique:
|
|
|
- Système isolé:
|
|
E - PROPRIETES ENERGETIQUES DES GAZ PARFAIT
- U ne dépend que de T (1ère loi de Joule):
|
|
CV est la capacité calorifique molaire à volume constant.
- Remarque importante:
 = 0 pour un gaz parfait qui évolue de façon isotherme ( même température
tout au long de la transformation ) ou monotherme ( même température finale
et initiale ) et
= 0 pour un gaz parfait qui évolue de façon isotherme ( même température
tout au long de la transformation ) ou monotherme ( même température finale
et initiale ) et 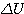 = 0 pour tout cycle d'un système, même si ce n'est pas un gaz et même si
la transformation est irréversibe.
= 0 pour tout cycle d'un système, même si ce n'est pas un gaz et même si
la transformation est irréversibe.
- H ne dépend que de T:
|
|
CP est la capacité calorifique molaire à pression constante.
- Relation de Robert Mayer:
|
|
Molaires.
- On pose:
|
|
Sans unité, supérieur à 1.
|
Atomicité du gaz parfait |
Exemples |
Cp |
Cv |
|
|
1 |
He, Ne, Ar, Kr... |
|
|
|
|
2 |
H2, N2, O2, air, HCl, Cl2.... |
|
|
|
Molaires,  est intensive.
est intensive.
- On en déduit:
|
|
|
Molaires.
- Travail des forces de pression au cours de transformations irréversibles et sans échange de matière:
Mis à part le cas trivial d'une transformation isochore ( V = Cte, alors W = 0 ), un autre cas simple est celui où la pression extérieure est constante, différente de celle du gaz puisque celle-ci peut ne pas être n'est pas définie ( pas la même pression en tout point, par exemple s'il y a des tourbillons dans le gaz ).
|
|
Homogène et signe correct.
- Travail des forces de pression au cours de transformations quasi-statiques et sans échange de matière:
a) transformations isochores:
|
|
b) transformations isobares:
|
|
PV est en joules.
c) transformations isothermes:


|
|

|
|
Un signe ( - ) est facilement oublié, un peu comme dans |
|
|
d- transformations adiabatiques:
Rappelons que nous sommes dans le cas des transformations:
- de gaz parfaits,
- quasi-statiques,
- sans échange de matière,
- sans échange de chaleur.

en remplaçant P par

on obtient:



|
|
Homogène à PV.
On peut ensuite remplacer le rapport des volumes par celui des pressions ou par celui des températures.
|
accueil sup |
page précédente |
page suivante |