
I - Titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de sodium:
1°) Etalonnage du pH-mètre:
Un pH-mètre est un voltmètre qui est sensible à la tension aux bornes de la sonde à laquelle il est relié.
Cette tension est une fonction affine du pH: u = a * pH + b ou réciproquement pH = a'* u + b'.
Pour que le pH-mètre indique le pH et non la tension, il faut relier ces 2 grandeurs grâce aux 2 constantes a et b ou a' et b'.
Cette dernière opération est réalisée expérimentalement en trempant l'électrode dans 2 solutions tampon au pH connu.
Une solution tampon est ansi appelée car son pH varie peu par dilution ou par contamination.

pH-mètre (passer le pointeur sur l'image)

pH-mètre (passer le pointeur sur l'image)
2°) Dispositif expérimental:

Montage pour un titrage (passer le pointeur sur l'image)

Sonde et barreau aimanté (passer le pointeur sur l'image)
3°) Courbe:
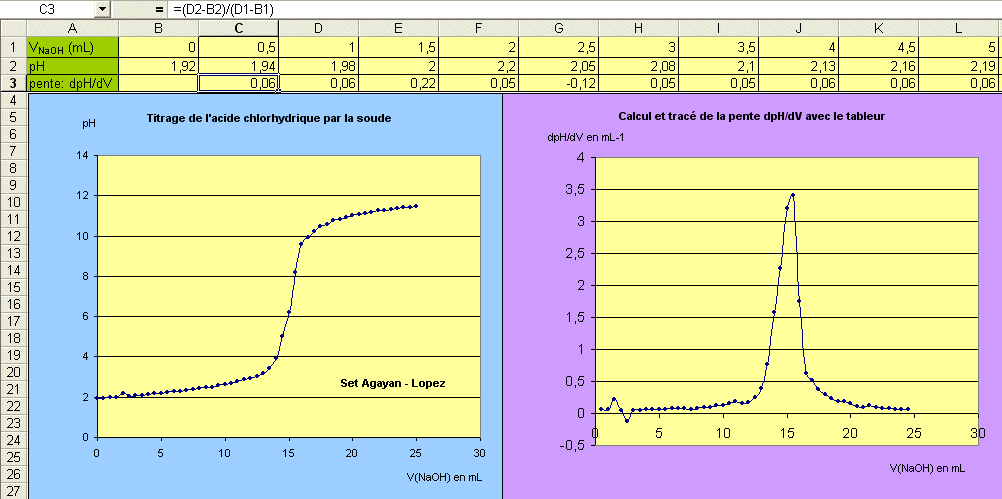
Regarder dans la zone de formule comment on calcule la pente moyenne pour la cellule C3.
4°) Interprétation:
Pour V= 0, le titrage n'a pas commencé et l'on a une solution d'acide chlorhydrique à la
concentration CA= 10-2 mol.L-1. Comme on l'a déjà vu,
cet acide est complètement dissocié:
HCl (aq) + H2O(l) —> H3O+(aq) + Cl-(aq)
et par conséquent, la concentration en ions H3O+ vaut, elle-aussi, [H3O+] = 10-2 mol.L-1 ce qui fait un pH = - log [H3O+] = - log 10-2 d'où pH = 2, en conformité avec les mesures. Au départ on a donc une quantité de matière d'ions H3O+: nA = CA VA = 10-2 * 20.10-3 = 2.10-4 mol.
Lors du titrage, l'ajout de solution de soude provoque la réaction:
H3O+(aq) + HO-(aq) —> 2 H2O(l), cette réaction est rapide et totale.
Au début, HO- est le réactif limitant mais lorqu'on a ajouté nB = CB VB = nA = 2.10-4 mol d'ions HO-, tous les ions H3O+ de l'acide ont été neutralisés. On dit qu'on est à l'équivalence car si on continue à ajouter de la soude, il y a changement de réactif limitant. A partir de l'équivalence, c'est H3O+ le réactif limitant. Maintenant, ce sont les ions HO- qui sont excédentaires.
A l'équivalence il y a égalité entre [H3O+] et [HO-], le pH vaut 7 et on lit VB = 16 mL.
A l'équivalence CA VA = CB VB, en effet 10-2 * 20.10-3 = 1,25.10-2 * 16.10-3 = 2.10-4 mol.
A l'équivalence on se retrouve avec une solution neutre qui contient des ions Cl- (provenant de l'acide chlorhydrique )et Na+ ( provenant de la solution de soude ) en quantités égales: on a de l'eau salée (solution de chlorure de sodium).
On peut définir l'équivalence comme étant le changement de réactif limitant.
Bien après l'équivalence, le pH tend vers celui d'une solution de soude de concentration 1,25.10-2 mol.L-1.
Or [H3O+] = Ke/[HO-] = 10-14/1,25.10-2 = 0,8.10-12 mol.L-1, d'où pH = - log [H3O+] = - log(0,8.10-12 ) d'où pH = 12,1, en accord avec l'allure de la courbe.
Notre discussion ne doit pas faire oublier que ce dosage est destiné à déterminer la concentration CA de l'acide.
5°) Animation virtuelle:
La forte pente à l'équivalence fait qu'un indicateur coloré vire (change de couleur) à la moindre goutte de soude ajoutée.
Ici, le meilleur indicateur coloré est le bleu de bromothymol (BdB ou BBT).
6°) Méthode des tangentes parallèles:
C'est une méthode graphique pour déterminer le point d'équivalence:

Technique du tracé:

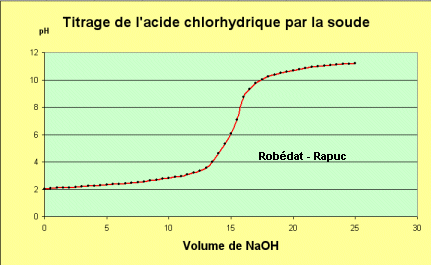
7°) Autres courbes de titrage obtenues pendant la séance:





II - Titrage d'une solution d'acide éthanoïque par une solution d'hydroxyde de sodium: