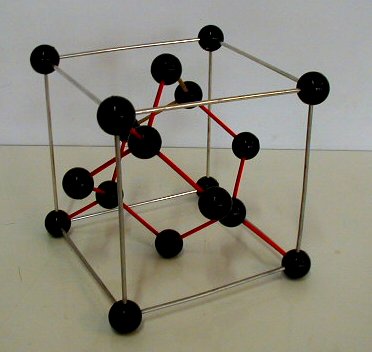
Diamant
|
Le diamant, comme le graphite, est du carbone pur. On peut considérer le cristal de diamant comme une molécule unique dans laquelle les atomes de carbone sont liés à leur 4 voisins par des liaisons covalentes tétraédriques, excluant toute faiblesse entre tel ou tel motif. Les liaisons C-C ont une longueur de 0,154 nm, comme dans les alcanes. Le diamant est très dense (d = 3,52), bien plus que la moyenne des roches de la croûte terrestre ( d = 2,5 ). Il a un indice de réfraction très élevé (n = 2,41 pour la raie D du sodium ), il fond à 3500 °C et bout vers 4700 °C.