

T1- Dans un domaine de pressions, l’équation d’état d’un gaz est:
|
|
où B ne dépend que de la température T.
Exprimer
le coefficient de dilatation à pression constante  et
le coefficient de compressibilité isotherme
et
le coefficient de compressibilité isotherme  du
gaz.
du
gaz.
Voir ou télécharger la correction ( par Geneviève GOMI, étudiante )
T2- Un gaz obéit à l'équation de Van der Waals:
|
|
où a et b sont des constantes.
Montrer que
|
|
et que
|
|
T3- Quelle augmentation de pression
faut-il exercer sur un liquide ou sur un solide pour supprimer sa dilatation
lors d'une élévation de température  T.
T.
|
Application numérique: |
|
|
|
Voir ou télécharger la correction ( par Geneviève GOMI, étudiante )
T4-
a) exprimer en fonction de  et de
et de  le travail
reçu par un système au cours d’une transformation élémentaire réversible en
fonction de dP et de dT.
le travail
reçu par un système au cours d’une transformation élémentaire réversible en
fonction de dP et de dT.
b)
examiner
le cas particulier du travail reçu lors d’une compression finie et isotherme
lorsque  et
et  sont supposés
constants (solides ou liquides).
sont supposés
constants (solides ou liquides).
T5-
Un solide passe d’un état A à un état C:
a)
au moyen
d’une transformation ABC.
b)
au moyen d’une transformation AC caractérisée par P =
P0
+ a T. Calculer le travail WAC
dans les 2 cas en supposant V, 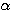 et
et  constants.
constants.
|
|
Un grand ballon fermé par un robinet contient un gaz parfait sous une pression initiale Pi = P0 - h. P0 est la pression
extérieure
et h l’indication d’un manomètre à mercure.
On ouvre brusquement le robinet puis on le referme. Le gaz subit alors une compression sensiblement adiabatique et
réversible,
suivie d’un refroidissement à volume constant ( la variation de volume du ballon
peut être négligée).
A
la fin du refroidissement la pression du gaz est devenue: Pf =
P0 -
h’. Exprimer  = Cp/Cv en
fonction de h et de h’.
= Cp/Cv en
fonction de h et de h’.
T7- Exprimer la pression en fonction de l’altitude dans l’atmosphère supposée se comportant comme un gaz parfait à
température
constante.
La pression au sol étant P0, pression atmosphérique normale , et la température étant de 20°C, calculer l’altitude à laquelle la
pression
est réduite à P0/10. On suppose g indépendant de l’altitude, égal
à 9,81.
T8- L’atmosphère est maintenant supposée adiabatique, vérifiant la relation:
|
|
Au
sol, pression =
P0 ,
température
= 20 °C, g = 9,81 m.s-2 et  =
1,4.
=
1,4.
Calculer à quelle altitude la pression vaut P0/10.
T9- Calculer la masse volumique de la vapeur d’eau à 100 °C considérée comme un gaz parfait.
T10- Un litre d’oxygène( O2 = 32 g.mol-1) à 20°C sous 3.105 Pa et 3 litres de dioxyde de carbone (CO2 = 44 g.mol-1) à
50°C sous 2.105 Pa sont mélangés dans un récipient de volume 5 litres à 40 °C. Calculer la pression et la masse molaire du
mélange.
Voir ou télécharger la correction ( par Geneviève GOMI, étudiante )
|
accueil général |
accueil Sup - Spé - DEUG |
page suivante |